U živočichů na nižším stupni vývoje nalézáme dosti velké rozdíly v dýchacích pigmentech, kdežto u těch živočichů, kteří jsou na vyšším stupni vývoje nacházíme je hemoglobin. Podrobněji byla studována bílkovina přenášející kyslík u hmyzího druhu rournatek. Bylo zjištěno, že se jedná o zelený chromoproteid obsahující železo a do protoporfyrinu se liší jen tím, že v poloze 2 místo vinylové skupiny osahuje skupinu aldehydovou – COH. Wartburg při měření fotodisociace CO – komplexu cytochromoxydazy poukázal na značnou podobnost spekter CO – komplexů cytochromoxydázy a chlorokruorinu. Předpokládal, že prostetické skupiny cytochromoxydásy a cytochromu a jsou podobně oxidované protoporfyriny.
U živočichů na nižším stupni vývoje slouží k přenosu kyslíku cytochromy, nikoliv však pigmenty. Hemoglobin, jako látka přenášející kyslík se ve vývojové řadě živočichů poprvé objevuje v nervových uzlinách nižších živočichů. Na vyšším stupni vývoje se objevuje v hemolymfě, například u měkkýšů. V hemolymfě lze taká nalézt jiná barviva sloužící k přenosu kyslíku, ale ve většině případů to není hemoglobin. Krevní barviva zde nejsou uzavřena v buňkách, ale jedná se o bílkoviny, které jsou rozpustné ve vodě.
Během vývoje se přenos kyslíku zdokonaluje a je umožněn přenos většího množství kyslíku. Toho lze dosáhnou zvýšením obsahu bílkoviny přenášející kyslík, ale tím se zvýší viskozita což vede k nadměrnému zatěžování srdce a krevního oběhu. Během fytogeneze se tento systém zdokonalil tak, že pigment, přenášející kyslík, je bílkovina o velké molekulové hmotnosti. Hemocyanin, který je obsažen v hemolymfě šneků a jiných druhů plžů. Je bílkovina, která má molekulovou váhu 0,4 – 6,7 milionů a obsahuje ionty mědi sloužící k přenosu kyslíku.
U některých druhů měkkýšů přenášejí kyslík molekuly podobné hemoglobinu, jejich molekulová váze je 1,5 milionu. U některých druhů na však hemoglobin váhu jen 34000 a je uzavřen v červených krvinkách. Bílkovina o malé molekulové váze uzavřena v červených krvinkách, již nezvyšuje viskozitu krve do takové míry, jak by tomu bylo, kdyby byla bílkovina volná. Velikost červených krvinek je opět různá. U ocasatých obojživelníků jsou erytrocyty 200 krát větší než u člověka, přesto 1 ml červených krvinek obsahuje vždy stejné množství hemoglobinu.
Hemu podobné sloučeniny
Chlorofyly
Ze zelených rostlin lze rozpouštědly extrahovat chlorofyl, jehož struktura je podobná struktuře heminu. Podstatný rozdíl je v tom, že chlorofyl sice obsahuje laktonový kruh, jeho centrálním atomem je však hořčík a v postraním řetězci je esterifikován jednou molekulou methanolu a jednou molekulou fytonu, obsahuje tudíž méně polárních skupin. Ve větším množství se vyskytují dva chlorofyly a a b; chlorofyl b obsahuje na třetím atomu formulovou skupinu a jeho absorpční spektrum se liší od spektra chlorofylu a. Roztok chlorofylu není schopen využívat energii slunečního světla v živé buňce se chlorofyl vyskytuje v chloroplastech. Tento komplex obsahuje i jiná barviva (deriváty karotinu). Izolované neporušené chloroplasty vykazují již plnou fotosyntézu.
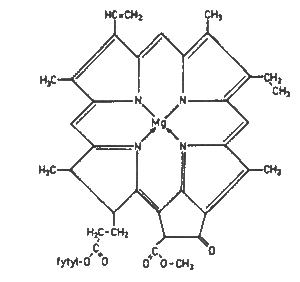
Chlorofyl
Cytochromy
Keilin zjistil, že ve tkáních jsou přítomné bílkoviny, které v anaerobních podmínkách vykazují podobnou absorbanci jako redukované heminové struktury. Avšak charakteristický absorpční pás však mizí po přidání oxidačních činidel.Redukované spektrum se však nemění přidáme-li ke tkáni kyanid nebo oxid uhelnatý.To ukazuje, že hemové deriváty zvané cytochromy netvoří s kyanidem ani oxidem uhelnatým komplexy.
Absorpční spektrum pásů cytochromů
Kleilin nejprve 3 druhy cytochromů a, b a c. Později prokázal, že pás a pochází od dvou látek a to cytochromu a a a3. Cytochromy se nejlépe pozorují v kvasnicích nebo svalech muších křídel, kde pozorování neruší hemoglobin.
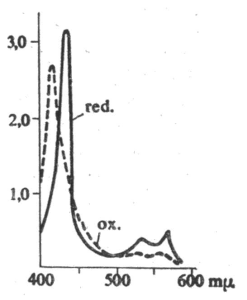
Absorbční spektrum cytochromu b
V čistém stavu je možno snadno připravit cytochrom c, který se ve tkáních vyskytuje v poměrně velké koncentraci. Tato bazická bílkovina s nízkou molekulovou váhou (11 800), ve které se k molekule bílkoviny váže molekula protoporfirinu IX, obsahující atom trojmocného železa. Atom železa lze snadno redukovat, ale ferrocytochrom c se vlivem molekulárního kyslíku neoxiduje zpět na ferricytochrom c (jen velmi pomalu). Hem cytochromu c je totožný s hemem hemoblobinu. Velký rozdíl spektra a funkce je dán pouze tím, že vazba mezi hemem v hemoglobinu a hemem v cytochromu se výrazně liší. Cytochromy jsou v oxidačním řetězci uspořádány za sebou to znamená že jeden může oxidovat druhý. Tímto způsobem jsou cytochromy schopné přenosu protonů.