Hemoglobin
V 5 litrech krve se nachází ¾ kg hemoglobinu, který je uzavřen v erytrocytech. Zředíme-li erytrocyty vodou nebo protřepeme-li je s chloroformem, jejich blána se zničí a hemoglobin se uvolní. Z roztoku se hemoglobin snadno vyloučí po změně pH, koncentrace solí nebo po přídavku malého množství ethylalkoholu. Pokud přidání probíhá za studena hemoglobin krystalu. V kyselém nebo alkalickém roztoku a také pod vlivem ethylalkoholu za pokojové teploty hemoglobin denaturuje a stává se nerozpustný ve vodě. Molekulová hmotnost je 66 000, molekula má téměř kuloví tvar. Ve vodě je dobře rozpustný, koncentrovaný roztok má tmavorudou barvu. Hemoglobin se skládá z bílkovinné části – globinu, na kterou se váže hem. V jedné molekule hemoglobinu nalezneme 4 molekuly hemu, které jsou uloženy symetricky na povrchu bílkoviny
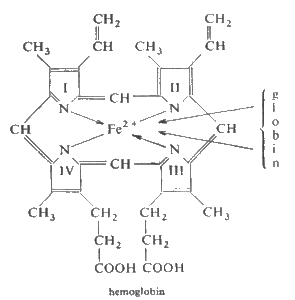
Hem je komplexní sloučenina jejíž centrálním atomem je iont Fe2+, k němuž se váže protoporfyrin IX.

hemoglobin
Vazba mezi globinem a hemem je velmi stabilní štěpí se jen ve velmi kyselém prostředí. Za těchto podmínek se dá globin izolovat, i když se bílkovina po odštěpení hemu stane labilnější než jak byla v hemoglobinu. V hemu má železnatý iont čtyři kovalentní vazby. K ferroiontu se váži ještě dva dusíky imidazolového jádra histidinu umístěného v polypeptidickém řetězci bílkoviny, a tak vzniká silná komplexní vazba mezi bílkovinou a její sprosteticou skupinou. Z těchto vazeb pocházejících z dusíku imidazolové skupiny histidinu, se jedna za přítomnosti kyslíku rozštěpí a na její místo se váže molekulární kyslík.
Za přítomnosti kyslíku se železo v hemoglobinu neoxiduje ne železitý iont , nýbrž ve formě železnatého iontu váže kyslík (ve formě O2) čili se oxigenuje. Tím se hemoglobin přeměňuje na oxyhemoglobin.
Místo molekuly kyslíku se na hemoglobin může vázat i jiná látka, které utváří se železnatými ionty komplexy. Jednou z nejvýznamnějších látek je oxid uhelnatý, protože se na hemoglobin váže mnohem silněji než kyslík. Proto se při studiu bílkovinné části připravuje mnohem stabilnější CO – hemoglobin (CO – Hb).
Izoelektrický bod hemoglobinu je 6,8, což ukazuje, že v bílkovinné části hemoglobinu je vázáno poměrně mnoho bazických aminokyselin. Velký význam má to že izoelektrický bod oxyhemoglobinu je 6,65. tato skutečnost umožňuje transport oxidu uhličitého aniž dojde ke změně pH.
Absorpční spektrum hemoglobinu je velmi charakteristické a umožňuje odlišit různé typy hemoglobinu. Absorpční spektra jsou uvedena na následujícím obrázku.
Kdybychom srovnávali absorpční spektra cytochromu c a hemoglobinu, zjistili bychom že jsou si velmi podobná, i když jsou zde viditelné rozdíly. Které jsou způsobeny různým druhem vazby hemu na bílkovinu cytochromu a hemoglobinu.působením oxidačních činidel na hemoglobin vzniká methemoglobin, který neváže kyslík v methemoglobinu se železo vyskytuje ve formě trojmocného železitého iontu. Působíme-li na oxyhemoglobin ferrikyanidem draselným, vznikne paradoxní jev, kdy oxidací hemoglobinu se uvolňuje kyslík.